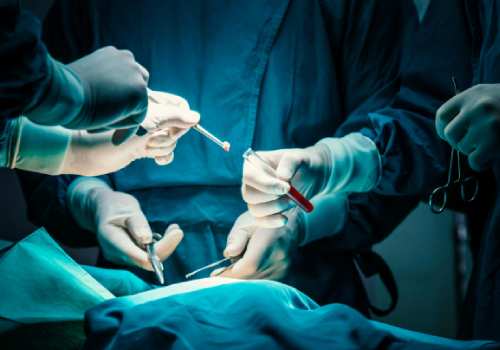
رحم اجاره ای

ارزیابی مایع منی
سندرم تخمدان پلی کیستیک و ART
سندرم تخمدان پلی کیستیک (PCOs) در باروری موفقیت آمیز اشکال ایجاد کرده به طوری که عدم تخمک گذاری در این زنان شایع است. اساس درمان این بیماری بر کنترل وزن، تغییر در سبک زندگی و تحریک تخمک گذاری با کلومیفن سیترات، متمرکز شده است. میزان بارداری تجمعی با کلومیفن پس از شش ماه در مان، حدود ۵۰-۴۰ درصد است و مابقی موارد را می توان با گنادوتروپین دوز کم، تحریک کرد. تکنیک های کمک باروری نیز به عنوان روش های مؤثری در بارداری این بیماران محسوب می شود. تحریک تخمک گذاری در مبتلایان PCO نیاز به یک رویکردی متفاوت، نسبت به زنان با تخمدان طبیعی دارد.
زنان PCO با خطر قابل توجهی از تحریک بیش از حد تخمدان و تشکیل کیست مواجه هستند. در این بیماران تعداد تخمک های جمع آوری شده زیاد بوده اما میزان لقاح آنها پایین می باشد. چند توضیح برای پاسخ بیش از حد تخمدان به تحریک در زنان مبتلا به PCO وجود دارد. تعداد فولیکول های آنترال افزایش یافته و گروهی از فولیکول های آنترال حساس به گنادوتروپین برونزا، انتخاب می شوند. هورمون آنتی مولرین (که یک گلیکوپروتئین دیمری تولید شده از سلولهای گرانولوزای فولیکول های آنترال و پره آنترال است)، در زنان PCO افزایش می یابد.
PCO و کیفیت تخمک
زنان مبتلا به PCO که تحت تحریک تخمدان در سیکل IVF قرار می گیرند، با خطر کاهش کیفیت تخمک، شکست در لانه گزینی واز دست دادن بارداری، روبه رو هستند. رابطه بین PCOs و کیفیت تخمک به چند دلیل، مبهم باقی مانده است. اولین و مهمترین آن، محدودیت انجام مطالعات تحقیقی بر روی وضعیت کیفی تخمک و جنین انسانی در علم زیست پزشکی است. دوم این که محیط کوچک هر فولیکول منحصر به همان فولیکول است و اثر خود را بر روی تخمک در حال توسعه خود، نشان می دهد.
سومین علت این است که در طول IVF که جنین های متعدد به طور همزمان به رحم منتقل می شوند بررسی روابط بین سطوح استروئیدی مایع فولیکولی و لانه گزینی موفق جنین مربوطه، دشوار و گیج کننده است. و نهایت این که کسب اطلاعات mRNA مادر، پروتئین ها و دیگر اجزای مولکولی در تخمک انسانی (به خصوص در طول رشد فولیکول اولیه دشوار است. کیفیت تخمک یکی از مهمترین عوامل تعیین کننده رشد و تکامل جنینی است. ویژگی های مورفولوژیکی تخمک می تواند کیفیت تخمک ، لقاح و جنین را پیش بینی کند. سندرم تخمدان پلی کیستیک ممکن است با نتایج ضعیف در تکنیک های کمک باروری همراه باشد، اما آنچه در حال حاضر مورد بحث است این است که آیا این امر به دلیل اختلال در کیفیت تخمک
نقص در پذیرش آندومتر و یا دیگر عوامل است. کیفیت بد تخمک، نتیجه میزان بیش از حد آندروژن و نقایص مولکولی ذاتی است که منجر به کاهش میزان لقاح و لانه گزینی در زنان مبتلا به PCOS می شود. از سوی دیگر، کیفیت نامطلوب تخمک ممکن است به متابولیسم غیر طبیعی چربی در زنان چاق مبتلا به PCOS مربوط باشد که در آن غلظت های بیشتر اسید لینولئیک و اسیدهای چرب هم در پلاسما و هم در مایع فولیکولی وجود دارد و ممکن است نتایج حاملگی IVF را در این بیماران کاهش دهد. واکنش های استرس اکسیداتیو در سلول های گرانولوزا در این زنان ، تا ۲۰ برابر افزایش می یابد و هم چنین میزان آپوپتوز نیز در این سلول ها بیشتر رخ می دهد که می تواند اثر نامطلوبی بر میزان موفقیت IVF داشته باشد.
به دلیل تفاوت در اختلالات متابولیکی بیماران PCOS تأثیرات بر کیفیت تخمک و جنین، متفاوت است. در برخی از خانم های مبتلا به PCOS که تحت تحریک تخمدان در سیکل IVF قرار گرفته اند، رشد جنین مناسب بوده و حاملگی طبیعی دارند، در حالی که در بعضی از آنها رشد و تکامل تخمک مختل شده است. به خصوص زنانی که اضافه وزن دارند، آسیب پذیر ترند و میزان تخمک لقاح یافته کمتر و شکست لانه گزینی بیشتری دارند. اختلال در کیفیت تخمک در بیماران PCOs با رشد و تکامل غیر طبیعی فولیکول ها مرتبط است. آندروژن تخمدان، هیپر انسولینمی و مقاومت به انسولین و اختلال در فاکتورهای رشد، تعاملات بین سلولهای گرانولوزا و تخمک را تحت تاثیر قرار داده و و بلوغ سیتوپلاسمی و هسته تخمک را دچار اختلال می کند.
PCO و آندومتر
اولیگومنوره شایع ترین تظاهر زنان مبتلا به عدم تخمک گذاری مزمن است. اما باید توجه داشت که بسیاری از زنان با عدم تخمک گذاری مزمن، آمنوره و یا خونریزی ناشی از اختلال عملکردی رحم دارند و حتی برخی از آنان دارای قاعدگی های منظم هستند. PCO معمولا با قاعدگی های نا منظم، الیگومنوره و یا آمنوره همراه است. عدم تخمک گذاری مزمن، چاقی و هایپر انسولینمی، همگی با خطر ایجاد سرطان آندومتر همراه هستند. به احتمال زیاد مکانیسم ایجاد سرطان، مربوط به تحریک استروژنی پایدار و بی وقفه بر آندومتر است که زمینه بروز الگوهای غیر طبیعی رشد آندومتر را، فراهم می کند.
در زنان مبتلا به PCOS که دارای تخمک گذاری کم و یا عدم تخمک گذاری هستند، نقش تنظیمی پروژسترون یا وجود ندارد و یا کمتر از حد مطلوب است. بنابراین رشد و تمایز آندومتر، تحت تأثیر آندروژن، انسولین و استروژن زیاد (بدون اثربخشی پروژسترون) قرار گرفته و در آندومتر، تغییر به فاز ترشحی رخ نمی دهد و به دلیل اثرات تحریک کننده و میتوژنیک مداوم استرادیول، خونریزی های غیر قابل پیش بینی، هیپرپلازی و سرطان آندومتر رخ می دهد. به طور کلی خطر ایجاد سرطان آندومتر ممکن است تا سه برابر افزایش یابد. در نتیجه، در افرادی که به مدت طولانی دچار عدم تخمک گذاری هستند، نمونه برداری از آندومتر برای رد هایپرپلازی آندومتر، اقدام مناسبی است.
آندومتر زنان مبتلا به PCOS یک مدل آندومتر ناکارآمد محسوب شده و در مقایسه با آندومتر زنان طبیعی، بیان بیش از حد گیرنده های آندروژنی و عدم تنظیم گیرنده های استروژنی در آن مشاهده می شود. برخی از مطالعات نشان می دهد که بافت آندومتر علاوه بر تکثیر سلولی، تمایز و پاسخ به محرک های بیولوژیکی، می تواند با عوامل دیگر مانند سیتوکاین ها و فاکتورهای رشد، تحت تاثیر قرار گرفته و سبب نتایج ضعیف باروری شود. زنان مبتلا به PCOS بیان نا منظم در مارکرهای پذیرش آندومتر دارند، به طوری که مطالعات نشان می دهد بیان اینتگرین های a5B3، ژن ها 10,11 HOX و فاکتور رشد شبه انسولینی (1-1GFBP) در طول مرحله ترشحی این افراد کاهش دارد.
اختلال در پذیرش آندومتر به نظر می رسد عامل اصلی محدود کننده ایجاد بارداری در تعداد زیادی از زنان از جمله مبتلایان PCOs باشد. لذا روش های درمانی به سمت بهبود میزان لانه گزینی، جهت گرفته است. قرص های ضد بارداری خوراکی (استروژن – پروژستینی) رایج ترین درمان برای اختلالات قاعدگی همراه با عدم تخمک گذاری مزمن هستند چون سبب ایجاد قاعدگی های دوره ای منظم و کاهش رشد بی وقفه آندومتر می شوند و از ایجاد خونریزی ناشی از اختلال عملکردی رحم جلوگیری و سبب از بین رفتن خطر هایپرپلازی و نئوپلازی آندومتر می شوند.
منبع: کتاب رویکردهای بالینی ناباروری در بیولوژی تولید مثل
همچنین بخوانید: